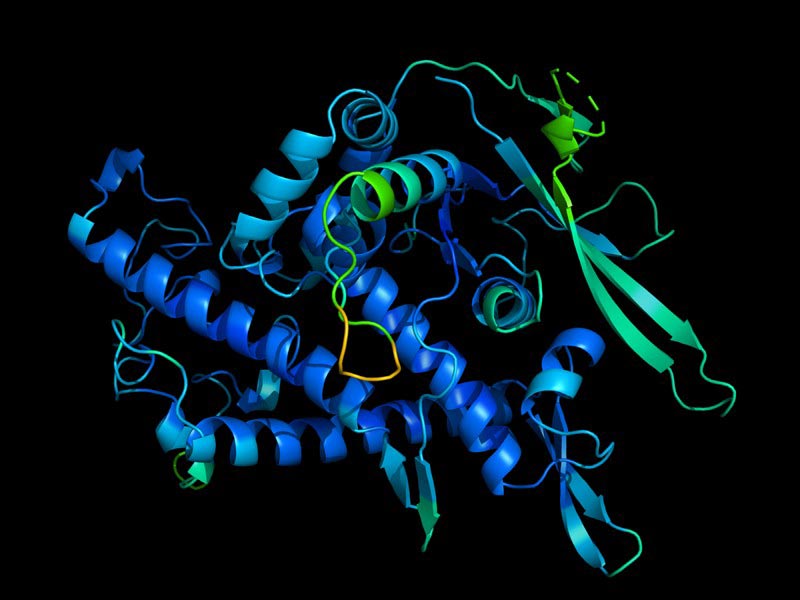
دانشمندان میگویند برنامه یادگیری عمیق گوگل برای تعیین اشکال سه بعدی پروتئینها، زیستشناسی را متحول خواهد کرد.
شبکه هوش مصنوعی (AI) که توسط شاخه گوگل دیپمایند توسعه یافته است، جهشی عظیمی را در حل یکی از بزرگترین چالشهای زیستشناسی ایجاد کرده است، تعیین شکل سهبعدی پروتئینها از توالی اسیدهای آمینه. در ادامه این مطلب شگفتانگیز با آیتیرسان همراه باشید.
برنامه دیپمایند که AlphaFold نام دارد، در چالش پیشبینی ساختار پروتئین دو سالهای به نام CASP، از 100 تیم دیگر بهتر عمل کرد. نتایج در تاریخ 30 نوامبر، در آغاز کنفرانس که امسال برگزار شد، اعلام شد.
جان مولت (John Moult)، زیست شناس محاسباتی در دانشگاه مریلند در کالج پارک، که برای بهبود روشهای محاسباتی خود برای پیشبینی دقیق ساختارهای پروتئینی، در سال 1994 بنیانگذار CASP شد، اکنون اینچنین اظهار نظر کرده است:
این واقعا مهم است، میتوان گفت اکنون مشکل حل شده است.
توانایی پیشبینی دقیق ساختارهای پروتئینی از توالی اسید آمینه یک مزیت بزرگ برای علوم زیستی و پزشکی است. این تلاشها برای درک عناصر سازنده سلولها و امکان کشف سریعتر و پیشرفته داروها را بسیار تسریع میکند.
برنامه هوش مصنوعی شرکت دیپمایند که AlphaFold نام دارد، در سال 2018 که اولین سال شرکت بود، در آخرین چالش پیشبینی ساختار پروتئین (CASP) در بالای جدول قرار گرفت؛ اما امسال، شبکه یادگیری این شرکت از بقیه رقبا بالاتر بود و به گفته دانشمندان، عملکرد بسیار گیج کنندهای داشت که میتواند نوید انقلابی در علم زیستشناسی باشد.
آندری لوپاس (Andrei Lupas)، زیستشناس تکاملی در موسسه زیست شناسی ماکس پلانک در توبینگن آلمان، که عملکرد تیمهای مختلف را در CASP ارزیابی کرده بود حالا اینچنین اظهار کرد:
این نوع از هوش مصنوعی باعث میشود برنامه کاملا عوض شود، این کشف دارو را تغییر میدهد. پژوهشها را تغییر خواهد داد. مهندسی زیستی را تغییر میدهد. به عبارت دیگر میتوان گفت این هوش مصنوعی همه چیز را دگرگون خواهد داد.
برنامه هوش مصنوعی دیپمایند (AlphaFold) قبلا به او کمک کرده است تا بتواند ساختار پروتئینی را که برای مدت یک دهه آزمایشگاه او را آزار داده است، پیدا کند و انتظار دارد که این عمل باعث تغییر نحوه کار و یافتن پاسخ سوالهایی شود که وی با آنها دست و پنجه نرم میکند.
در برخی موارد، پیشبینیهای ساختار AlphaFold با استفاده از روشهای آزمایشی استاندارد طلا مانند کریستالوگرافی اشعه ایکس و میکروسکوپ الکترونی-برقی (cryo-EM) که در سالهای اخیر تعیین شده بود، قابل تشخیص نبودند. دانشمندان میگویند که برنامه AlphaFold ممکن است نیاز به این روشهای پرزحمت و گرانقیمت را برطرف نکند، اما هوش مصنوعی امکان مطالعه موجودات زنده را به روشهای جدید فراهم خواهد کرد.
مشکلات ساختاری
پروتئینها عناصر سازنده زندگی هستند و بیشتر آنچه که در داخل سلولها اتفاق میافتد، بر عهده آنها است. نحوه کار و عملکرد پروتئین توسط شکل سه بعدی آن تعیین میشود. ساختار تابعی از زیست شناسی مولکولی است. پروتئینها تمایل دارند بدون کمک موجود دیگری، شکل بگیرند و این فقط توسط قوانین فیزیک هدایت میشود.
برای دههها آزمایشات آزمایشگاهی اصلیترین راه برای بدست آوردن ساختارهای پروتئینی مناسب بوده است. اولین ساختارهای کامل پروتئینها با تکنیکی که در آن پرتوهای اشعه ایکس به پروتئینهای متبلور وارد میشوند، شروع شد و نور پراکنده شده به مختصات اتمی پروتئین تبدیل شد. کریستالوگرافی اشعه ایکس سهم مهمی از ساختارهای پروتئینی را تولید کرده است. اما طی دهه گذشته، میکروسکوپ الکترونی کرایو (Cryo-EM) به ابزار مورد علاقه بسیاری از آزمایشگاههای زیست شناسی ساختاری تبدیل شده است.
اکنون مدتهاست که دانشمندان از خود میپرسند که چگونه اجزای تشکیل دهنده یک پروتئین یا رشتهای از آمینواسیدها، بسیاری از پیچ و تابهای شکل نهایی آن را ترسیم میکند. محققان میگویند که تلاشهای اولیه در استفاده از رایانه برای پیشبینی ساختارهای پروتئینی در دهه 1980 و 1990 عملکرد ضعیفی داشته است. بقیه ادعاهای منتشر شده افرادی مانند محققان نیز هنگامی که سایر دانشمندان از آنها برای پروتئینهای دیگر استفاده میکنند، نقض شدند.
جان مولت، زیست شناس محاسباتی، CASP را برای دقت بیشتر در این تلاشها راهاندازی کرد. این رویداد تیمها را به چالش میکشد تا ساختار پروتئینهایی را که با استفاده از روشهای آزمایشی حل شدهاند، اما ساختارها برای آنها عمومی نشده است، پیشبینی کنند. مولت این آزمایش را با پیشرفت بسیار زیاد در زمینه آزمایش، با در نظر گرفتن ادعاهای دیگر، اعتبار میبخشد.
جان مولت اینچنین اظهار کرده است:
در این مرحله واقعا میتوانید بفهمید که چه چیزهایی امیدوارکننده به نظر میرسند، چه عواملی موثر هستند و اینکه همچنین در این زمینه باید از چه چیزهایی دوری کنیم!
جینبو کو (Jinbo Xu)، زیستشناس محاسباتی در دانشگاه شیکاگو، ایلینوی اینجنین گفته است که عملکرد دیپمایند در سال 2018 در CASP 13 بسیاری از دانشمندان این حوزه را که مدتها در گروههای کوچک دانشگاهی بوده است، مبهوت کرد، اما رویکرد آن کاملا مشابه روش سایر تیمهایی است که از هوش مصنوعی استفاده میکنند.
اولین بازگویی AlphaFold روش هوش مصنوعی را که به عنوان یادگیری عمیق در دادههای ساختاری و ژنتیکی شناخته میشود، برای پیشبینی فاصله جفت اسیدهای آمینه در یک پروتئین اعمال کرد. در دومین مرحله که هوش مصنوعی را استفاده نمیشود، AlphaFold از این اطلاعات برای تهیه مدلی کلی از شکل ظاهری پروتئین استفاده میکند.
طبق گفتههای جامپر (Jumper)، تیم سعی داشت این روش را ادامه دهد اما در نهایت به موانعی برخورد کرد. بنابراین این روند تغییر کرد و شبکه هوش مصنوعی جدیدی ایجاد کرد که شامل اطلاعات اضافی در مورد محدودیتهای فیزیکی و هندسی است که نحوه چیدمان پروتئین را تعیین میکند. آنها همچنین کار دشوارتری را پیش روی خود دارند: شبکه به جای پیشبینی روابط بین اسیدهای آمینه، ساختار نهایی توالی پروتئین هدف را پیشبینی میکند. او اینچنین اظهار کرده است:
این سیستم، سیستمی کاملا پیچیدهتر است.
دقت بالا
این برنامه پیشبینی پروتئین، CASP طی چندین ماه انجام میشود. پروتئینهای هدف یا بخشی از پروتئینها در کل حدود 100 عدد، به طور منظم آزاد میشوند و تیمها چندین هفته فرصت دارند تا پیشبینی ساختار خود را ارائه دهند. سپس تیمی از دانشمندان مستقل پیشبینیهایی با اندازهگیری ساختار تعیین شده از طریق آزمایش را اندازهگیری میکنند. این افراد نمیدانند چه کسی را آن را پیشبینی خواهد کرد.
طبق گفتههای لوپاس (Lupas)، پیشبینیهای AlphaFold با نام گروه 427 ارائه شده است، اما دقت حیرتانگیز بسیاری از اطلاعات ثبتشده آن باعث برجستهتر شدن آنها شده است. او در این باره میگوید:
حدس زده بودم که این پیشبینیها، کار برنامه AlphaFold باشد. بیشتر مردم نیز این مسئله خبر داشتند.
برخی از پیشبینیها از بقیه بهتر بود، اما تقریبا دو سوم از نظر کیفیت با ساختارهای آزمایشی قابل مقایسه بودند. مولت در این باره اینچنین گفته است که در برخی موارد اصلا مشخص نبود که آیا اختلاف بین پیشبینیهای AlphaFold و نتیجه آزمایش خطایی در پیشبینی است یا محصولی مصنوعی از آزمایش.
پیشبینیهای برنامه AlphaFold با ساختارهای آزمایشی تعیین شده توسط تکنیکی به نام طیف سنجی تشدید مغناطیسی هستهای مطابقت نداشت، اما این میتواند از دادههای خام به مدل تبدیل شود. این شبکه همچنین تلاش میکند ساختارهای تکی را در مجتمعهای پروتئینی یا گروهها مدلسازی کند، در نتیجه تعاملات با سایر پروتئینها شکل آنها را تغییر میکند.
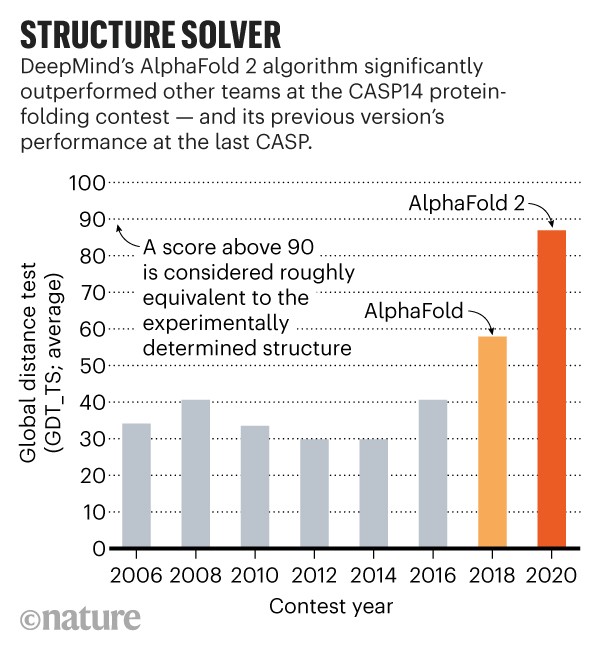
مولت در این مورد اینچنین گفته است که به طور کلی، تیمها در سال جاری ساختارها را با دقت بیشتری پیشبینی کردند و در مقایسه با آخرین CASP، میتوان گفت پیشرفت بسیاری در AlphaFold دیده شده است. در مورد اهداف پروتئینی که نسبتاً دشوار تلقی میشوند، بهترین عملکرد سایر تیمها به طور معمول 75 در مقیاس 100 نقطه دقت پیشبینی بوده است، این در حالی است که AlphaFold در همان اهداف حدود 90 را به دست آورد.
مولت نیز اینگونه اظهارنظر کرده است که در حدود نیمی از تیمها خلاصه این پژوهش را در خلاصه مقاله رویکرد خود ذکر کردهاند و معتقد است که هوش مصنوعی تأثیر گستردهای در این زمینه دارد. بیشتر این افراد از تیمهای دانشگاهی بودند، اما مایکروسافت و شرکت فناوری چینی Tencent نیز وارد CASP14 شدند.
محمد الغراشیه (Mohammed AlQuraishi)، زیست شناس محاسباتی در دانشگاه کلمبیا در شهر نیویورک و یکی از شرکتکنندگان CASP، مشتاق است که جزئیات عملکرد AlphaFold را در این مسابقه جستجو کند و هنگامی که تیم دیپمایند رویکرد خود را در 1 دسامبر ارائه میدهد، در مورد نحوه کار سیستم اطلاعات بیشتری کسب کند. او اینچنین بیان کرد که ممکن است محصولات پروتئینی آسانتر از حد معمول در عملکرد موثر بوده است. باور بزرگ او این است که AlphaFold در حوزه هوش مصنوعی تحولآفرین خواهد بود.
محمد الغراشیه گفته است:
فکر میکنم منصفانه باشد که بگوییم این امر در زمینه پیشبینی ساختار پروتئین بسیار نوآورانه خواهد بود. من گمان میکنم بسیاری از افراد این حوزه را ترک خواهند کرد، زیرا بدون شک مشکل اصلی حل شده است. این مانند موفقیتی در مرتبه اول است، مطمئنا یکی از مهمترین نتایج علمی زندگی من نیز خواهد بود.

سریعترین ساختارها
پیشبینی AlphaFold به تعیین ساختار پروتئین باکتریایی که آزمایشگاه لوپاس سالهاست سعی در شکستن آن دارد، کمک کرده است. تیم لوپاس پیش از این دادههای پراکنده شده اشعه ایکس خام را جمعآوری کرده بود، اما تبدیل این الگوهای Rorschach مانند به ساختار به اطلاعاتی در مورد شکل پروتئینها نیاز دارد. اکنون ترفندهای که در بدست آوردن این اطلاعات و همچنین سایر ابزارهای پیشبینی کمک میکرد، با شکست مواجه شدهاند. لوپاس گفته است:
پس از گذشت یک دهه که همه چیز را امتحان کردیم، مدل گروه 427 در عرض نیم ساعت به ما ساختار موردنظر را ارائه داد.
دمیس حسابیس (Demis Hassabis)، بنیانگذار و مدیر اجرایی دیپمایند در این باره اینچنین گفته است که این شرکت قصد دارد AlphaFold را برای دانشمندان قابل استفاده کند تا دیگران نیز بتوانند از آن استفاده کنند. (قبلا جزئیات کافی در مورد نسخه اول AlphaFold را برای سایر دانشمندان منتشر کرده تا این رویکرد را تکرار کند.) ایجاد یک ساختار پیشبینی شده که شامل تخمینهای مربوط به مناطق مختلف پروتئین باشد، میتواند روزها طول بکشد.
حسابیس که دارو را کشف کرد و طراحی پروتئینها را از کاربردهای بالقوه خود میداند، اینچنین اضافه کرده است:
تازه درک کردهایم که زیست شناسان چه میخواهند.
استفان بروهاون (Stephen Brohawn)، متخصص مغز و اعصاب مولکولی در دانشگاه کالیفرنیا در برکلی که تیمش این ساختار را در ماه ژوئن منتشر کرد، اینچنین گفته است که در اوایل سال 2020، این شرکت پیشبینیهای کمی از ساختارهای پروتئینهای ویروس کرونا (SARS-CoV-2) را که هنوز به طور آزمایشی تعیین نشده بود، منتشر کرد. پیشبینی دیپمایند در مورد پروتئینی به نام Orf3a در نهایت بسیار شبیه به پروتئینی است که بعدا از طریق میکروسکوپ الکترونی کرایو تعیین شد. او اینچنین اضافه کرد:
کاری که آنها توانستهاند انجام دهند، بسیار چشمگیر است!
تأثیر این کشف در دنیای واقعی
بعید است AlphaFold باعث شود آزمایشگاههایی مانند بروهاون بسته شود. این آزمایشگاهها از روشهای تجربی برای حل ساختارهای پروتئینی استفاده میکند. اما این روش میتواند به معنای آن باشد که دادههای آزمایشی با کیفیت پایینتر و آسانتر برای جمعآوری تمام آنچه برای دستیابی به ساختار مناسب لازم است، باشد. برخی از کاربردها، مانند تجزیه و تحلیل تکامل پروتئینها، اکنون قرار است به طور کامل شکوفا شوند، زیرا این حجم از دادههای ژنومی موجود ممکن است اکنون به ساختارها تبدیل شوند. لوپاس گفته است:
این امر میتواند نسل جدیدی از زیست شناسان مولکولی را قادر به طرح سوالات پیشرفتهتر کند. این کشف به تفکر بیشتر و اندازهگیری کمتری احتیاج خواهد داشت.
ژانت تورنتون (Janet Thornton)، زیست شناس ساختاری در آزمایشگاه زیست شناسی مولکولی اروپا، موسسه بیوانفورماتیک اروپا در هینکستون، انگلستان و ارزیابیگر گذشته CASP در این باره اینچنین گفته است:
این مشکلی است که من فکر میکردم در طول زندگی هرگز حل نخواهد شد.
او امیدوار است که این روش بتواند به روشن شدن عملکرد هزاران پروتئین حل نشده در ژنوم انسان کمک کند و تغییرات ژنی ایجاد کننده بیماری را که در افراد متفاوت است، معنا کند.
عملکرد AlphaFold به مانند نقطه عطفی برای دیپمایند است. این شرکت بیشتر به خاطر داشتن هوش مصنوعی برای تسلط بر بازیهایی مانند Go مشهور است، اما هدف طولانیمدت آن توسعه برنامههایی با توانایی دستیابی به هوش گسترده و شبیه انسان است. حسابیس نیز گفته است که مقابله با چالشهای بزرگ علمی، مانند پیشبینی ساختار پروتئین، یکی از مهمترین کاربردهایی است که هوش مصنوعی میتواند آن را انجام دهد. او در این باره گفت:
فکر میکنم این مهمترین کاری بوده است که برای این دنیا انجام دادهایم، بیشک این عمل تأثیرات زیادی در دنیای واقعی خواهد داشت.